Механика |
Третий закон термодинамикиТретий закон - основной закон термодинамики. Он был открыт в результате исследований в области низких температур. Открытие второго начала термодинамики подтвердило, что существует абсолютный нуль температуры, предсказанный еще Ломоносовым, первым исследователем низких температур, впервые сумевшим заморозить ртуть и искусственно получить очень низкую температуру (-65° С). Из уравнения второго начала термодинамики 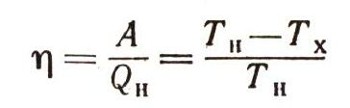 следует, что возможно существование такой предельно низкой температуры, при которой все тепло QH, взятое от нагревателя, может быть полностью превращено в работу. Как видно из уравнения, это осуществимо только при ТХ = 0. Это и есть термодинамическое определение абсолютного нуля. Энтропийный метод расчета направления термодинамических процессов обладает существенным недостатком. Как мы уже знаем, чтобы рассчитать возможность любого процесса, нужно знать как изменение энтропии системы, так и изменение энтропии источников теплоты — и тех, от которых система получает тепло, и тех, которым это тепло отдает. Но изменение энтропии системы часто бывает очень трудно определить, а иногда даже совсем невозможно. Такой расчет ведь может быть проведен только с помощью обратимого процесса. А для этого нужно знать, при каких условиях изучаемая система может находиться в равновесии. Те исследователи, которые захотели бы на основании только одного второго начала термодинамики рассчитать процесс получения алмазов, должны были бы экспериментально, на опыте изучить, при каких условиях графит находится в равновесии с алмазом, подобно тому как лед с водой. Затем им пришлось бы осуществить при этих условиях превращение графита в алмаз, измерив теплоту превращения. А это практически невозможно. Необходимость экспериментально определить условия равновесия очень снижает ценность энтропийного принципа, но, конечно, не обесценивает его. Зная изменение энтропии при одних условиях, можно рассчитать его при любых других значениях температуры и давления. Такие энтропийные расчеты — главное содержание большой самостоятельной науки — химической термодинамики. Вычисляя изменение энтропии, нельзя обойтись одним вторым началом без того, чтобы на опыте не изучить равновесное состояние при каких-либо определенных условиях. Эта большая принципиальная трудность была термодинамикой преодолена. Изучение поведения вещества вблизи абсолютного нуля, в области очень низких температур, и теоретические исследования теплоемкости тел на основе квантовой теории привели к установлению еще одного — третьего закона термодинамики, который впервые был высказан известным немецким физико-химиком В. Нернстом. 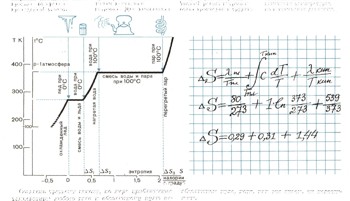 Рассмотрим на примере воды, как надо рассчитывать энтропию. Прежде
всего нужно выбрать начальное состояние системы. Пусть это будет состояние
льда при 0°С. Во всех процессах, протекающих при постоянной температуре,
изменение энтропии находится очень просто - оно равно приведенной теплоте
обратимого процесса Q/Т. Это справедливо и для плавления льда, и для испарения
воды. Для нагревания воды расчет усложняется: ее температура при нагревании
от 273 К до 373 К изменяется непрерывно. Поэтому приходится суммировать
бесконечно малые изменения энтропии. Для вычисления энтропии нужно знать
теплоемкость и теплоту превращений. Теплоемкость воды С=1 калории на грамм
при изменении температуры на 1 градус. Для воды теплота плавления равна
80 калориям на грамм. Теплота испарения при 100°С 539 калорий на грамм.
Точный расчет энтропии очень громоздок и труден. Приходится учитывать,
как влияет на изменение теплоемкости не только изменение температуры, но
и изменение давления.
Согласно третьему закону, по мере приближения температуры, любого тела к абсолютному нулю изменение его энтропии при изменении его любого свойства тоже стремится к нулю и становится предельно равным нулю при достижении абсолютного нуля. Хотя эта формулировка и звучит подобно детской скороговорке, она выражает очень важный закон природы. Знание его сильно повысило возможность термодинамического предсказания : 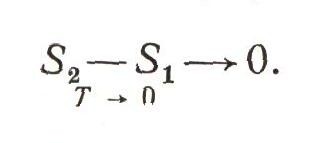 Это математическое выражение третьего закона позволяет полностью рассчитать химическую реакцию, не проводя никаких предварительных экспериментальных исследований химического равновесия. Решая проблему синтеза алмаза, исследователи были освобождены благодаря третьему закону от необходимости предварительно изучить хотя бы одно равновесие между алмазом и графитом. Раз и навсегда для любой системы, а следовательно и для алмаза, стало известным изменение энтропии при абсолютном нуле, хотя, как мы знаем, он недостижим. На этом примере мы рассмотрим, как решается термодинамикой расчет возможности осуществить новое, неизвестное химическое, превращение. В основе расчета теперь лежит знание, как изменяется энтропия при переходе графита в алмаз при абсолютном нуле. По третьему закону это изменение равно нулю. Зная теплоемкости графита и алмаза в пределах от абсолютного нуля вплоть до высоких температур, всегда можно вычислить, как изменяется энтропия при превращении графита в алмаз при любой температуре. По уравнению состояния графита и алмаза можно вычислить изменение энтропии и для любого давления. Далее нужно еще знать теплоту перехода графита в алмаз (чтобы вычислить изменение энтропии источника теплоты). Ее можно найти, измерив теплоту сгорания и графита и алмаза. Из этих данных, по закону Гесса, легко найти теплоту перехода, нужную для расчета. По известным теплоемкостям и уравнению состояния можно пересчитать теплоту перехода от ее значения при обычных условиях на любые значения температуры и давления. Таким путем и могут быть получены все данные, необходимые для того, чтобы можно было предсказать условия, при которых возрастает общая энтропия в процессе превращения графита в алмаз, при которых может, следовательно, происходить самопроизвольное образование алмаза. Этот термодинамический расчет требует предварительных точнейших исследований теплоемкостей, точного знания уравнений состояния в очень широких пределах температуры и давления. Но такой термодинамический расчет был проведен советскими исследователями, и этот расчет полностью оправдался. В СССР был с успехом осуществлен промышленный синтез алмазов. Без термодинамики это было бы невозможно. Полмиллиарда уравненийТермодинамика основана всего на четырех законах (закон термического равновесия, о котором рассказано в начале статьи, тоже является одним из основных законов термодинамики). Эти законы представляют собой обобщение огромного опыта, накопленного наукой в течение столетий. Пользуясь могучим аппаратом математики, и в первую очередь методами дифференциального исчисления, термодинамика устанавливает связи между самыми разнообразными явлениями и процессами. Ее всеобщие законы приложимы ко всем отраслям физики и химии: к свойствам газов, жидкостей и твердых тел, к химическим реакциям, к магнитным и электрическим явлениям. Они приложимы к грандиозным космическим процессам, изучаемым астрофизикой. Ее выводы неоспоримы и незыблемы. Один известный ученый подсчитал общее число уравнений, которые могут быть получены термодинамикой: их число оказалось невообразимо большим - свыше 500 млн. уравнений. А ведь каждое из них отражает реальную закономерность, действительную связь между свойствами вещества, между явлениями, протекающими в нашем реальном мире. Без термодинамики не было бы и не могло бы быть современной теплотехники, не было бы химической промышленности, не было бы металлургии, не существовала бы, в частности, и промышленность удобрений. Синтез аммиака из водорода и азота, синтез искусственного жидкого топлива, синтез алмазов - во всем этом проявилась мощь термодинамики. В совокупности знаний, без которых нельзя вывести на орбиту космический корабль, термодинамика занимает важное место. Без помощи термодинамики не может обойтись ни одна область естествознания, ни одна точная наука. В области своего применения термодинамика обладает такой большой возможностью предсказания, что по справедливости может быть названа "грядущего вестником". Тот, кто знает и любит термодинамику, овладел ее методами и научился их применять, поистине может быть назван современным кудесником. Термодинамику должен изучить каждый, кто любит науку, какой бы из отраслей знаний он ни собирался посвятить свою жизнь. Тайна вихряСтрашен смерч в океане. Вихрем до самого неба поднимает воду из морской пучины. Беда, если неосторожный капитан не успеет увести свой корабль с его пути. Еще страшнее смерч в пустыне. Гигантские воздушные вихри несут горы горячего песка, вырывают с корнем деревья, разрушают дома, могут унести из каравана путника вместе с верблюдом. По древней легенде храбрец, повстречавший в пустыне смерч на своем пути, должен смело к нему подскакать и, не дрогнув, метнуть в него кинжал: смерч исчезнет, а на стальном лезвии останутся капли холодной росы - это "кровь шайтана", пораженного смелым воином. Удивительно, как часто скрывается истина в старых поэтических легендах. Может быть, сотни лет знали жители пустынь о сильном холоде в середине вихревого столба смерча. Но ученые-физики сумели подметить это замечательное явление совсем недавно. Оказывается, во всяком воздушном вихревом движении температура наружных слоев вихря выше, чем в окружающем воздухе, а в центре значительно ниже. И хотя до сих пор теоретики еще не смогли до конца понять и объяснить причину этого эффекта и его механизм далеко не ясен, инженеры заставили "шайтана смерчей пустыни" послушно работать в холодильных установках. |
 |