Электричество и магнетизм |
КристаллыХолодное зимнее небо роняет снежинки. Они невесомо спускаются на нашу ладонь, тают и падают с руки прозрачными шариками - каплями воды. Если взглянуть на снежинку через лупу, обнаружится сказочное явление: шестилучевая звездочка, и каждый луч ее состоит из шестигранных столбиков (гексагональных призм). Это кристаллы льда - твердой воды. Твердое состояние вещества - кристаллическое. В кристаллах с первого взгляда поражает их правильная форма, у каждого вещества своя. Твердое тело может быть монокристаллическим, т. е. состоять из одного-единственного кристалла, или поликристаллическим, т. е. состоять из многих кристаллов, иной раз очень мелких, например в тысячную долю миллиметра (1 мкм).  Рис. 1. У кристаллов различных веществ различная геометрическая форма.
Слева направо: у поваренной соли - куб; у алмаза - октаэдр; у берилла -гексагональная
призма.
Кристаллы имеют форму многогранников с плоскими гранями (рис. 1). Кристаллы поваренной соли (NaCl) образуют кубы. Кристаллы алмаза-октаэдры, восьмигранники. Кристаллы полудрагоценного камня берилла - гексагональные призмы, торцы которых покрыты тончайшим узором. Не каждый ювелир смог бы воспроизвести такой узор! В кристаллографии приняты названия, производные от греческих слов: "эдра" - грань, "гонос" - угол; октаэдр - восьмигранник, гексагон - шестиугольник. Симметрия. Основные внешние признаки твердого тела - его правильная "от природы" кристаллическая форма и плоскогранность. Правильность формы выражена в его симметрии, т. е. в свойстве совмещаться в разных положениях с положением исходным. Для наглядности процесс совмещения, именуемый операцией симметрии, осуществляется с помощью элементов симметрии.  Рис. 2. У кубического кристалла поваренной соли три взаимно перпендикулярные
оси симметрии четвертого порядка, четыре оси третьего порядка и шесть осей
второго порядка.
Если кубический кристалл NaCl повернуть на 90° вокруг оси, проходящей через центры противоположных граней, кристалл совместится с исходным положением. При полном повороте вокруг оси на 360° кристалл NaCl совместится с исходным положением четырежды (рис. 2). Поэтому кубический кристалл NaCl обладает тремя осями симметрии четвертого порядка (они показаны на рисунке), а также четырьмя осями третьего порядка (объемные диагонали куба) и шестью осями второго порядка (они проходят через центры противоположных ребер).  Рис. 3. Плоскость симметрии (зеркало) перпендикулярна поверхности
кадра и делит ее пополам. Отражение в зеркале симметрично с фигурой девочки,
стоящей на палубе.
На рисунке 3 мы видим пример другой, зеркальной, симметрии.: левая половина рисунка совмещается с правой, как предмет со своим отражением в зеркале. Вместо оси симметрии здесь существует другой элемент симметрии - плоскость симметрии. На рисунке 3 плоскость симметрии пересекает плоскость рисунка по линии, делящей рисунок вертикально. Плоскости симметрии есть и у кристалла NaCl. 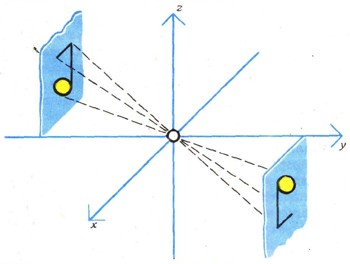 Рис. 4. Центр инверсии (симметрии).
В некоторых кристаллах наблюдается еще один вид элементов симметрии - центр инверсии, или центр симметрии. Он делит пополам прямые, которые соединяют противоположные, равные, параллельные, но обратно направленные (антисимметричные) части фигуры (рис. 4). На рисунке 5 показан кристалл анортита, имеющий только центр симметрии. Для наглядности две антисимметричные грани даны голубым цветом. (Центр симметрии есть и в кристалле NaCl.) Понятие антисимметричных фигур широко используется в физике. Ниже мы встретимся с антисимметричными электронами (принцип Паули).  Рис. 5. Кристалл анортита.
Монокристаллы и поликристаллические вещества. В производстве меди или стали расплав охлаждают быстро, и отдельные кристаллики не успевают подрасти. Получается поликристаллическое твердое тело. Металлические предметы, окружающие нас в быту, от вилки до подъемного крана, состоят из поликристаллических веществ. Кристаллическую структуру такого вещества можно увидеть через микроскоп. Поликристаллические вещества, как мы знаем, состоят из мелких монокристаллов. Но не следует думать, что монокристаллы всегда мелки. В природе нередко встречаются крупные монокристаллы. Они вырастают в результате длительных процессов, протекающих в земной коре. Например, монокристаллы кварца, химический состав которого тот же, что и у речного песка (SiО2), вырастают до десятков сантиметров в поперечнике. В Ленинградском горном институте хранятся монокристаллы кварца, найденные на Урале и на Украине. Высота одного из них 85 см, высота другого 83 см. Массы их 800 и 500 кг. В связи с развитием новой техники появилась потребность как в мелких, так и в крупных монокристаллах германия, кремния и других веществ. Иногда оказываются нужными кристаллические иглы, нити и даже тончайшие пленки. Все эти "капризы" приборостроительной промышленности удовлетворяются научными лабораториями и специальными заводами. Анизотропия. Многие свойства монокристаллов зависят от направления, в котором эти свойства измеряются. Зависимость физических свойств от направления называется анизотропией. Например, теплопроводность кристалла, измеренная в различных направлениях, может оказаться неодинаковой. Она будет одинаковой лишь в параллельных и симметричных направлениях. То же можно сказать об электропроводности, твердости, прочности и других свойствах. Иначе говоря, симметрия внешней формы сопровождается в монокристаллах симметрией физических свойств. 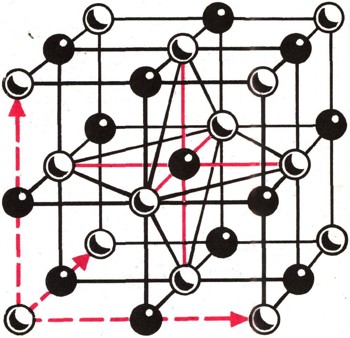 Рис. 6. У каждого атома в кристалле поваренной соли шесть соседей,
они расположены по трем взаимно перпендикулярным осям.
Анизотропия проявляется весьма наглядно. Из монокристаллов кварца, к примеру, изготовляют пьезоэлектрические пластинки (см. ст. "Звук"). Вырезать их нужно под строго определенными углами к осям симметрии, к граням и ребрам кристалла и для разных назначений пластинки - под разными углами. Ошибся в углах среза - получится бракованный прибор. Симметрия внешней формы и симметрия физических свойств, на первый взгляд кажущиеся чудом, вызваны симметрией внутреннего строения кристалла, т. е. расположением атомов в твердом теле. Элементарная ячейка кристаллической решетки. Исследование методами рентгеновского анализа показало, что правильная форма кристаллов (например, NaCl) вызвана правильным расположением в пространстве ионов (в нашем примере Na+ и С1 ), или атомов; расстояния между атомами в кристалле строго равны в каждом данном направлении, как, например, между центрами квадратов шахматной доски. Эта особенность определяется понятием "дальний порядок". Наименьшее количество атомов кристалла, сохраняющее при уменьшении его размеров присущий данному кристаллу дальний порядок, называется элементарной ячейкой. На рисунке 6 показана элементарная ячейка кристалла NaCl. Длина ребра ее равна 0,563 нм, расстояние между центрами ионов Na+ (белые) и С1- (черные) равно 0,2815 нм. Из элементарных ячеек слагается кристаллическая решетка твердого тела, состоящая из огромного количества атомов. Атомы, или ионы, образуют узлы кристаллической решетки. Промежутки между узлами, "незанятые позиции", называют между-узлиями. 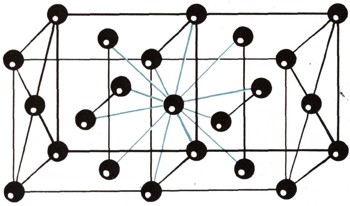 Рис. 7. В кристалле меди у каждого атома двенадцать соседей.
В кристаллической решетке NaCl ионы Na+ и С1-образуют соответствующие подрешетки натрия и хлора, как бы вставленные друг в друга. На рисунках изображены также структуры: меди (рис. 7), графита (рис. 8) и алмаза (рис. 9). У каждого атома в решетке меди 12 соседей, в решетке NaCl - 6 соседей, в решетке алмаза - 4. 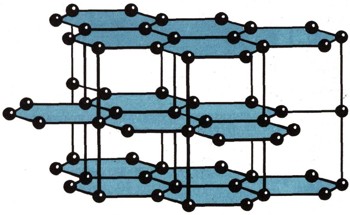 Рис. 8. Кристаллическая структура графита.
Так как в решетке NaCl расстояние между ионами равно 0,2815 нм, то вдоль 1 см вещества (ребра куба) уложилось бы 35,5 млн. (3,55 * 107) атомов. Следовательно, в 1 см3 монокристалла поваренной соли около 4,45*1022, т. е. (3,55*107)3 атомов. 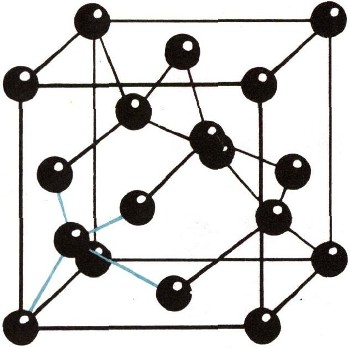 Рис. 9. Структура алмаза.
Трудно представить себе такое колоссальное количество. Поясним его таким примером. Если бы в сосуд было помещено 4,5*1022 атомов (скажем, гелия) и ежесекундно из этого сосуда вылетал бы миллион атомов, то за год количество атомов уменьшилось бы в сосуде на 3,2*1013. А за миллион лет оно уменьшилось бы всего на 3,2*1019 атомов, т. е. менее чем на одну тысячную первоначального количества (4,5*1022). Напомним, что в одном моле любого простого вещества число атомов еще больше (число Авогадро NA = 6,022*1023). Структура кристалла и анизотропия. Даже в кубической структуре типа NaCl, в которой расстояния между атомами одинаковы по трем направлениям, в других направлениях (кроме этих трех) свойства кристалла, например механические, сильно отличаются. Происходит это не только потому, что в других направлениях межатомные расстояния другие, но и вследствие иного распределения сил связи между атомами. Возьмем, например, направление объемной диагонали. Перпендикулярно ей чередуются плоскости, образующие грани октаэдра (рис. 6). Каждая из этих плоскостей состоит только из одного типа ионов (или Na+, или С1-). Силы притяжения, возникающие между такими плоскостями, в 5,8 раза больше, чем между плоскостями, параллельными граням куба, в каждой из которых лежат и те и другие ионы: и Na+ и С1-. Вот почему кристалл NaCl гораздо легче расколоть по плоскостям куба, чем по плоскостям октаэдра. Поэтому же и кристаллизуется поваренная соль, образуя кубы. Непонятная на первый взгляд "прихоть" природы оказывается вполне объяснимой. У алмаза тоже кубическая решетка. Но атомы углерода предпочитают образовывать октаэдриче-ские кристаллы. Каждый атом в алмазе окружен четырьмя соседями в вершинах тетраэдра, четырехгранника (рис. 9). Расстояние между ними одинаково, строго равно 0,154 нм. Такие короткие связи очень прочны, недаром алмаз - самое твердое природное вещество на Земле, Все четыре связи одинаковы, но, если из алмаза вырезать симметричный куб, количество связей, проходящих через единицу поверхности на грани такого куба, значительно больше, чем на грани октаэдра. Поэтому-то алмаз гораздо легче раскалывается (и кристаллизуется) по граням октаэдра, а не по граням куба.
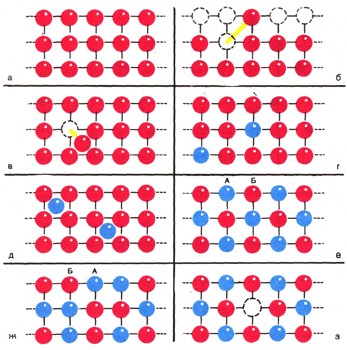 Рис. 10. Структуры реальных кристаллов: а - идеальный кристалл; б
- структура Шоттки, атомы переползают из глубин кристалла на поверхность,
оставляя внутри незанятые узлы; в - структура Френкеля, атомы смещаются
из узлов в междуузлия; г - структура замещения, атомы примеси проникают
в кристалл и размещаются в узлах; д-структура внедрения примеси в междуузлия;
е - сплав АВ с бездефектной структурой; ж - сложная структура взаимозамещения
А на Б и Б на А; з - структура вычитания, некоторые узлы остаются вакантными.
В некубических кристаллах закон анизотропии проявляется еще более разительно. На рисунке 8 показана кристаллическая гексагональная решетка графита. Графит, как и алмаз, состоит из атомов углерода. Но атомы образуют в элементарной ячейке не тетраэдры, а шестиугольные кольца. В пределах слоя этих колец расстояние между атомами одинаково и равно всего 0,145 нм. Эти связи очень прочны, прочнее, чем у алмаза. У каждого атома в слое три связи. Четвертая же связь, перпендикулярная слою, очень длинна - 0,335 нм - и поэтому слаба. Она легко рвется. Графит хорошо расщепляется вдоль слоев решетки и очень мягок. В направлениях, параллельных и перпендикулярных слоям, в графите резко отличаются не только твердость, но и теплопроводность, электропроводность и многие другие свойства. Реальные кристаллы. В идеальном кристалле, каким мы только что его описали, дальний порядок охватывает миллионы миллионов атомов. В тех же кристаллах, которые существуют в природе, т. е. в реальных кристаллах, этот порядок чаще всего нарушен (рис. 10). В простом веществе, допустим в меди, атомы могли бы занять все узлы решетки только при абсолютном нуле, т. е. при О К. При более высокой температуре атомы переползают из глубины кристалла на его поверхность, оставляя внутри незанятые узлы, "вакансии". Такое строение называется структурой Шоттки. При еще более высокой температуре атомы просто смещаются с узлов в междуузлия - образуется структура Френкеля. Атомы примесей могут проникнуть в кристалл и занять места в свободных узлах. Такое построение называется структурой замещения. Могут они поместиться и в междуузлиях, тогда возникает структура внедрения. В химических соединениях или сплавах, например АБ, их компоненты могут образовывать между собой структуры взаимозамещения. При повышении температуры все больше атомов одного компонента проникает в позиции второго компонента и, наоборот, атомы второго компонента - в позиции первого. Беспорядок в кристаллах усиливается. В химии полупроводников чрезвычайно важны структуры вычитания, когда в соединении АБ один вид атомов (обозначенный синим) частично отсутствует. Такие структуры содержат меньшее число атомов А или Б. На рисунке 10, з этот дефект показан пунктиром. Все эти нарушения правильной структуры кристаллов в отдельных узлах или междуузлиях называются точечными дефектами. Они очень влияют на механические, электрические и другие свойства кристаллов. Кроме точечных дефектов в твердых телах и стеклах возникают и протяженные дефекты (трещины, сдвиги), которые также отражаются на многих свойствах вещества, например на прочности. Механическая прочность тела. Железная проволока сечением 1 мм2 разрывается силой 981 Н; ее сопротивление разрыву 981*106 Н/м2. У стеклянной нити того же сечения сопротивление разрыву в 10 раз меньше (в среднем). Можно ли считать, что это подлинная прочность стекла? Советские ученые доказали, что если вместо одной толстой стеклянной нити площадью сечения 1 мм2 взять стеклянное волокно из 1000 нитей (площадь сечения каждой 0,001 мм2), то прочность такой составной нити возрастет примерно в 10 раз, т. е. сравняется с прочностью железной проволоки. Причина такого загадочного явления оказалась прежде всего в... трещинах. Если одна-единственная крохотная трещина возникает в волокне площадью сечения 1 мм2, то под действием нагрузки эта трещина начинает быстро удлиняться, пока волокно не лопнет. Если та же трещина возникает в одном из 1000 тончайших волоконец нити, то это волокно также разорвется, но другие 999 волокон останутся неповрежденными, и стеклянная нить выдержит нагрузку. Это замечательное явление уже используется в технике. Стеклянное волокно, склеенное пластмассой,-стеклопластик - прочный материал. Из него можно делать детали машин, корпуса катеров и лодок не менее прочные, чем из стали, но гораздо более легкие. Многим любителям рыбной ловли известны великолепные удилища, а спортсменам - лыжные палки из стеклопластика. Они легки и очень прочны. Такие свойства реальных кристаллов и стекол открывают перед техникой новые возможности. Если нужно резко повысить прочность твердого тела, не всегда обязательно создавать новое вещество. Устранив дефекты, можно во много раз повысить прочность уже известного вещества. Чтобы понизить прочность твердого тела и тем самым облегчить его помол (дробление), можно ввести в него так называемые поверхностноактивные вещества, которые проникают по трещинам в глубь кристалла и значительно облегчают его раскалывание (см. ст. "Замечательные явления на границах между телами"). |
 |