Введение |
Великое испытание периодического закона26 октября 1868 г. на заседании Парижской академии, наук были прочитаны одно за другим два письма. Одно было прислано из Индии, от французского астронома Жансена, другое - из Англии, от английского астронома Локьера. Оба сообщали, что в спектре солнечных протуберанцев они (независимо друг от друга) обнаружили новую желтую линию, которая не может принадлежать ни одному химическому элементу из существующих на земном шаре. Было решено, что новая линия в спектре принадлежит какому-то особому "небесному" элементу. Он был назван древнегреческим именем Солнца - гелий. Спустя 25 лет после открытия гелия на Солнце знаменитый английский физик Джон Рэлей обнаружил очень странный факт: плотность чистого азота, добытого из воздуха, больше плотности того же азота, полученного из любого азотного соединения. Разница была ничтожна - тысячные доли грамма на литр, но она была. Рэлей написал об этом письмо в лондонский журнал "Природа". Он спрашивал, не сумеет ли кто-нибудь из читателей журнала объяснить, почему "воздушный" азот тяжелее. Но ответов не последовало. Тогда Рэлей обратился к своему другу - известному английскому химику Рамзаю, и они решили, что каждый из них не покинет свою лабораторию, пока загадка не будет разгадана. Они работали разными методами и, наконец, нашли, что в обычном воздухе существует какая-то примесь, и не малая: в каждом литре воздуха содержится около 10 см3 еще неизвестного газа. Они дали ему имя аргон. Странный это был газ. Подобных веществ химики еще не знали. Никакими средствами им не удавалось заставить его вступать в химические реакции. Это и было выражено в его названии: по-гречески "аргон" значит "ленивый". Аргон оказался новым химическим элементом. Затем Рамзай узнал, что известный химик Гильде-брант наблюдал некоторые минералы (они содержали уран или торий), которые при нагревании выделяют какой-то негорючий газ. Рамзай решил проверить, не аргон ли это. Но газ, выделившийся из минерала клевеита, оказался не аргоном. У него был совершенно другой спектр, отличный от уже изученного спектра аргона. Рамзай дал ему имя "криптон" ("тайный") и послал запаянную пробирку с "криптоном" одному из опытных спектроскопистов английскому химику и физику Круксу для точного исследования спектра. В ответ он получил телеграмму: "Криптон - это гелий. Приходите и поглядите. Крукс". Так газ, впервые за четверть века до этого найденный на Солнце, был наконец обнаружен на Земле. Гелий оказался самым легким газом после водорода. Но периодический закон не предусматривал существования >таких химических элементов, как гелий и аргон. Для них в периодической системе не было пустых клеток. Куда же поместить новые элементы? Скептики снова воспрянули духом, снова зазвучали голоса сомневающихся в периодической системе и периодическом законе. Но это продолжалось недолго. В 1897 г. Рамзай прочел доклад, который он озаглавил так: "Еще не открытый газ". Рамзай сказал: "По образцу нашего учителя Менделеева я описал, поскольку возможно было, ожидаемые и предполагаемые соотношения газообразного элемента, который должен был бы заполнить пробел между гелием и аргоном". Места для гелия и аргона в таблице нашел Рам-зай. Они были помещены в новый, нулевой, столбец между седьмым, где были фтор и хлор, и первым, где разместились металлы, подобные литию и калию. Отсюда следовало, что должен существовать газ, столь же инертный, как аргон, но легче его -с атомным весом 20. Руководствуясь предсказанными свойствами, Рамзай предпринял поиски нового газа и нашел его в сжиженном воздухе. Этот газ получил название "неон", что значит "новый", а вскоре были найдены и остальные элементы новой группы: криптон, ксенон и затем радон. 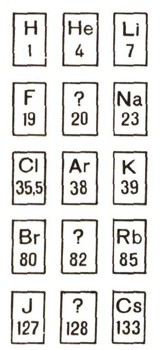 Так были предсказаны Рамзаем на основании периодической системы благородные газы. По существу это было сделано совершенно так же, как Менделеев предсказал галлий, германий и скандий. Все пустые места вскоре заняли вновь открытые элементы: неон, криптон и ксенон. Атомные веса на карточках приближенные. Из нового испытания периодический закон вышел с победой. Иначе и не могло быть! После этого ни у кого в мире не оставалось сомнения в истинности периодического закона Менделеева. Этот успех был заслуженным. Великий закон доказал единство вещества во Вселенной. Он внес стройность и порядок в невообразимую путаницу бесчисленного множества фактов, наблюдений, измерений, накопленных химией к середине прошлого века за сотни лет. Он дал могучий метод для изучения химических элементов и их свойств. Сам Менделеев исправил атомные веса многих элементов, известных ранее, в том числе, например, урана. Периодический закон дал возможность предсказывать новое - это истинный закон природы. Но не все было ясно в периодическом законе. Были необъяснимые исключения: атомный вес аргона (39,9) оказался большим, чем атомный вес калия (39,1), а аргон в таблице стоит перед калием. Атомный вес кобальта превышал атомный вес никеля, хотя по свойствам кобальт в периодической системе должен был предшествовать никелю. И у теллура, стоящего перед иодом, атомный вес оказался больше, чем у иода. Не только это было неясным в таблице. Было твердо установлено, сколько должно быть элементов в первых периодах таблицы, но оставалось совершенно неясным, сколько элементов должно быть в ее последних периодах. Самое же главное, что было неясным,- это сам периодический закон. Он требовал от науки решить величайшую, казалось бы, неразрешимую задачу: объяснить периодичность химических свойств у элементов, из которых состоит весь окружающий нас мир. |
 |