Беседа о самом необыкновенном в мире веществе |
Топливные элементыВот уже почти столетие ученые многих стран ищут пути прямого преобразования химической энергии дешевого топлива в электрическую. Создать топливные элементы оказалось чрезвычайно трудно. Во-первых, обычное топливо так медленно поддавалось электрохимическому окислению, что о мало-мальски приемлемой мощности не могло быть и речи. Во-вторых, топливные элементы были чрезвычайно недолговечны. До середины текущего столетия создание надежных и эффективных топливных элементов многим казалось бесперспективным. Но энтузиасты-исследователи продолжали развивать теоретические основы электрохимии, они искали новые материалы и новые катализаторы. Их исследования увенчались успехом. Ученые уверены: проблема будет решена, и решена сравнительно скоро. Подтверждение тому — новые образцы топливных элементов. Как же они устроены? Топливный элемент существенно отличается от обычного гальванического элемента старого типа. Топливо и окислитель для электрохимической реакции не закладываются в него заранее, а непрерывно подводятся к нему во время работы. Для удобства компоненты подводят в газообразном или жидком состоянии. От тепловой машины топливный элемент отличается тем, что окисление происходит в нем не химическим путем (путем горения), а электрохимическим. При обычном химическом окислении электроны с молекул топлива переходят на частицы окислителя. Если бы этот переход был упорядочен, т. е. совершался преимущественно в одном направлении, мы получили бы электрический ток. Но в пламени частицы топлива и окислителя перемешаны и электронный переход совершается хаотично, во всех направлениях. Энергия процесса рассеивается в виде тепла. Смысл электрохимического окисления как раз и заключается в упорядочении электронных переходов. Для этого прежде всего необходимо разделить частицы топлива и окислителя. Рассмотрим простейшую электрохимическую реакцию окисления водорода кислородом. Водород подводится к электроду, выбранному так, чтобы на нем могла протекать реакция окисления водорода с образованием водородных ионов и электронов: 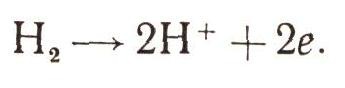 Другой электрод выбирается таким образом, чтобы на нем подаваемый кислород мог восстановиться в воду: 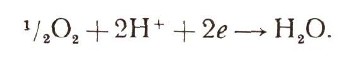 Если соединить электроды металлическим проводником (электрической цепью), то реакции на обоих электродах все время будут протекать слева направо. Образующиеся на первом электроде электроны по внешней цепи переходят на второй электрод — по цепи течет электрический ток, который совершает работу. Электрическая цепь замыкается электролитом, в котором образующиеся ионы водорода также переносятся ко второму электроду. Необходимая для работы электрическая энергия получается за счет энергии химического процесса. Суммарная химическая реакция, протекающая на обоих электродах, — реакция образования воды: 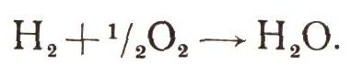 Сложность создания топливных элементов заключается в подборе электродов (и электролита), которые были бы достаточно активны. Чтобы увеличить скорость электрохимических реакций, как и реакций химических, часто используют катализаторы. Катализаторы находятся на поверхности или в порах электродов. |
 |