Химия жизни |
Пространственная структура белковОднако установить первичную структуру белка еще недостаточно, чтобы полностью понять его свойства, ведь белок не простая линейная молекула. Входящие в состав белка остатки аминокислот взаимодействуют между собой, образуя определенные пространственные структуры; наиболее характерная из них — спиральная. Образование водородных связей и определенные пространственные ограничения приводят к тому, что длинная полипептидная цепь легко свертывается в спираль; на каждый ее виток приходится 32/3 аминокислотного остатка (т. е. 11 аминокислот располагаются в виде примерно трех витков а-спирали). Таким образом, длинные цепи белков имеют вид толстых спиралей (рис. 2). 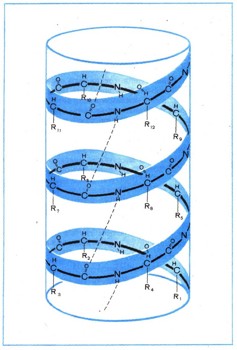 Рис. 2. Схематическое изображение а-спирали полипептидной цепи, а-спираль стабилизируется водородными связями (пунктирные линии) между группами С—О и N—Н аминокислот, находящихся в цепи на расстоянии четырех остатков друг от друга. Выяснением вторичной структуры, белка, т. е. той формы, которую приобретает белковая нить, построенная из аминокислот, изучение формы белковой молекулы не заканчивается. Оказывается, возникшие спирали (помимо спиральной существуют и другие формы вторичной структуры) далее взаимодействуют между собой, образуя очень сложный, но строго определенный по форме клубок. Размещение спиралей в таком клубке называют третичной структурой белка (рис. 3). Иногда сложившиеся определенным образом громадные молекулы белка могут взаимодействовать между собой, как бы слипаясь. Такое слипание (ассоциацию) белков называют четвертичной структурой. Небольшие изменения во вторичной, третичной и четвертичной структурах меняют характер биологического действия. 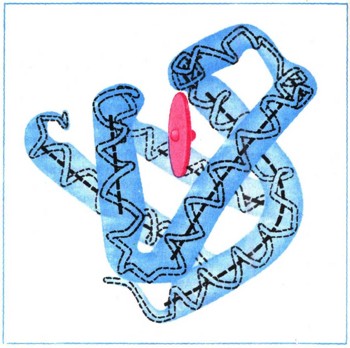 Рис. 3. Третичная структура мышечного белка миоглобина. Красный диск (на рисунке) соответствует положению тема — железосодержащего участка белка. Очень сложная форма белков, особенно белковых катализаторов — ферментов, возникает при образовании третичной и четвертичной структур. Это приводит к тому, что некоторые аминокислотные остатки, находящиеся далеко друг от друга в полипеп-тидной цепи, фактически сближаются; они могут образовать определенную структуру — активный центр, который обеспечивает высокую реакционную способность фермента. Так, например, в молекуле протеолитического (т. е. расщепляющего белки) фермента химотрипсина, который активно участвует в пищеварении, пространственно сближенными оказываются аминокислоты, находящиеся в цепи на 57, 102 и 195-м местах. При этом боковые цепи аминокислот приобретают способность осуществлять реакции, которые не способны проводить в отдельности, т. е. проявляют кооперативное действие. Функции отдельных групп разграничены: одни закрепляют расщепляемое вещество в определенном месте (тогда его концентрация резко возрастает и реакции могут протекать быстрее), другие группы как бы растягивают в расщепляемом веществе те связи, которые разрываются третьими группами, и т. д. (рис. 4). 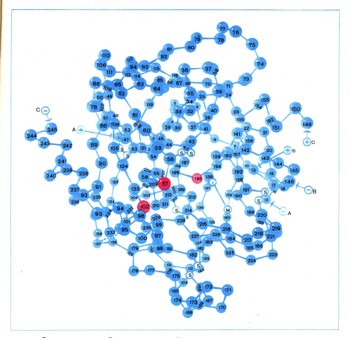 Рис. 4. Схема пространственного строении протеолитического фермента химотрипсина. На рисунке видно, насколько пространственно сближены аминокислотные остатки, находящиеся в первичной структуре на далеком расстоянии (номера в кружочках обозначают последовательность аминокислот в полипептидной цепи). Особенности строения ферментов, выработавшиеся за время длительного эволюционного развития, делают их исключительно сильными и специфическими катализаторами. Например, одна молекула фермента каталазы обеспечивает распад в течение одной минуты около 5 млн. молекул перекиси водорода (при нормальной температуре тела). Каталаза в миллионы раз эффективнее, например, такого катализатора, как ионы трехвалентного железа. Ферментные системы азотфиксирующих бактерий позволяют связывать молекулярный азот воздуха при комнатной температуре и нормальном давлении, а в технике этот процесс проводят, применяя различные катализаторы, при давлении в десятки мегапаскалей и температуре выше 500° С. Удивительно высока специфичность ферментов, их «умение выбирать» определенные молекулы из ряда очень похожих. Фермент глюкозоксидаза окисляет Лишь один определенный изомер глюкозы, не затрагивая не только других Сахаров, но и других пространственных изомеров глюкозы. Дальше, при описании механизма биосинтеза белка, будет рассказано об одном из этапов этого сложного процесса — присоединении аминокислот к соответствующим макромолекулам (транспортным рибонуклеиновым кислотам). Осуществляющие эту реакцию особые ферменты безошибочно выбирают из 20 аминокислот и из 20 очень сходно построенных макромолекул только нужные пары и соединяют их. |
 |