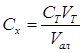- Главная
- Авиация и космонавтика
- Административное право
- Акционерное право
- Английский
- Антикризисный менеджмент
- Биографии
- Автомобильное хозяйство
- Автотранспорт
- Культура и искусство
- Маркетинг
- Международное публичное право
- Международное частное право
- Международные отношения
- Менеджмент
- Металлургия
- Муниципальное право
- Налогообложение
- Оккультизм и уфология
- Педагогика
- Политология
- Право
- Предпринимательство
- Психология
- Радиоэлектроника
- Риторика
- Социология
- Статистика
- Страхование
- Строительство
- Схемотехника
- Таможенная система
- Теория государства и права
- Теория организации
- Теплотехника
- Технологии
- Товароведение
- Транспорт
- Трудовое право
- Туризм
- Уголовное право и процесс
- Управление
- Сочинения по литературе и русскому языку
- Другое
Контрольная работа: Анализ почвыКонтрольная работа: Анализ почвыФЕДЕРАЛЬНОЕ АГЕНСТВО ПО ОБРАЗОВАНИЮ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ «ЛИПЕЦКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙЦ УНИВЕРСИТЕТ» Кафедра химии Зачетная задача по предмету: «Аналитические методы анализа в мониторинге объектов окружающей среды» на тему:«Анализ почвы» Выполнил: студент ХМФ гр. АХ-06-1 Ирхина Э.Е. Проверил: Дергунова Елена Сергеевна Липецк 2010 г. Введение Почва – особое природное образование, сформировавшееся в результате длительного преобразования поверхностных слоев литосферы под совместным взаимообусловленным взаимодействием гидросферы, атмосферы, живых и мертвых организмов. Почва состоит из органических, минеральных, органоминеральных комплексных соединений, почвенной влаги, воздуха и живых существ, населяющих ее. Почва является одним из элементов биосферы, которые обеспечивают циркуляцию химических веществ в системе окружающая среда — человек. Причем это относится не только к эндогенным химическим веществам, но и к экзогенным химическим веществам, поступающим в почву с выбросами промышленных предприятий, сточными водами, выбросами авто- и авиатранспорта, при обработке сельскохозяйственных земель Почва является местом сбора и хранения большого числа загрязнителей, куда они попадают в результате техногенной деятельности человека и выбросов загрязнителей из природных источников. Она не обладает свойством подвижности, характерным для других природных сред, и наиболее подвержена загрязнению. Кроме того, многие соединения, попадая в почву, вследствие химических и микробиологических превращений могут стать более токсичными, чем исходные. Из почвы может происходить загрязнение воды, воздуха, пищевых продуктов и других элементов биосферы канцерогенными и радиоактивными веществами. Вследствие этого необходимо регулярно проводить мониторинг почв в различных раонах города и области. В данной зачетной задаче проводился общий анализ почвы, отобранной в Усманском районе, Липецкой области. 1 Мониторинг почв Мониторинг состояния почв предназначен для регулярных наблюдений за химическим загрязнением почв, их состоянием; обеспечивает сбор, передачу и обработку полученной информации в целях своевременного выявления негативных процессов, прогнозирования их развития, предотвращения вредных последствий и определения степени эффективности осуществляемых природоохранных мероприятий. В отличие от воды и атмосферного воздуха, которые являются лишь миграционными средами, почва является наиболее объективным и стабильным индикатором техногенного загрязнения. Она четко отражает эмиссию загрязняющих веществ и их фактического распределения в компонентах городской территории. Наиболее крупные промышленные города образуя обширные зоны загрязнений, постепенно превращаются в сплошные техногенные территории, представляющие серьезную опасность для здоровья проживающего на них населения. В этой связи, постоянное наблюдение за содержанием промышленных токсикантов в почвах и тенденцией их содержанием является наиболее актуальным. Одним из наиболее мощным факторов, приводящим к загрязнению окружающей среды, является промышленность. Зона существенного загрязнения почв химическими элементами в окрестностях промышленных предприятий занимает площадь радиусом 10 км с гораздо большей протяженность (до 30 км и более) в направлении господствующих ветров, а также в направлении стока поверхностных и грунтовых вод. Источниками загрязнения почвы являются: · выбросы вредных веществ в атмосферный воздух от стационарных и передвижных источников загрязнения; · полигоны промышленных и бытовых отходов; · несанкционированные свалки промышленных и бытовых отходов; · средства химической защиты растений и минеральные удобрения. На загрязнение почвы значительное влияние оказывают проливы нефтепродуктов, неорганизованные сбросы ливневых и талых вод, а также санитарное состояние городской территории. Классификкация почв Основной единицей классификации почв является тип почв. Понятие «тип почв». Под типом почв понимают почвы, образованные в одинаковых условиях и обладающие сходными строением и свойствами. К одному типу почв относятся почвы: · 1) со сходными процессами превращения и миграции веществ; · 2) со сходным характером водно-теплового режима; · 3) с однотипным строением почвенного профиля по генетическим горизонтам; · 4) со сходным уровнем природного плодородия; · 5) с экологически сходным типом растительности. Широко известны такие типы почв, как подзолистые, черноземы, красноземы, солонцы, солончаки и др. Каждый тип почв последовательно подразделяется на подтипы, роды, виды, разновидности и разряды. Подтипы почв представляют собой группы почв, различающиеся между собой по проявлению основного и сопутствующего процессов почвообразования и являющиеся переходными ступенями между типами. Например, при развитии в почве наряду с подзолистым процессом дернового процесса формируется подтип дерново-подзолистой почвы. При сочетании подзолистого процесса с глеевым процессом в верхней части почвенного профиля формируется подтип глееподзолистой почвы. Подтиповые особенности почв отражаются в особых чертах их почвенного профиля. При выделении подтипов почв учитываются процессы и признаки, обусловленные как широтнозональными, так и фациальными особенностями природных условий. Среди последних первостепенную роль играют термические условия и степень континентальности климата. В пределах подтипов выделяются роды и виды почв. Роды почв выделяются внутри подтипа по особенностям почвообразования, связанным прежде всего со свойствами материнских пород, а также свойствами, обусловленными химизмом грунтовых вод, или со свойствами и признаками, приобретенными в прошлых фазах почвообразования (так называемые реликтовые признаки). Роды почв выделяются в каждом типе и подтипе почв. Самые распространенные из них: · 1) обычный род, т. е. отвечающий по своему характеру подтипу почв; при определении почв название рода «обычный» опускается; · 2) солонцеватые (особенности почв определяются химизмом грунтовых вод); · 3) остаточно-солонцеватые (особенности почв определяются засоленностью пород, которая постепенно снимается); · 4) солончаковатые; · 5) остаточно-карбонатные; · 6) почвы на кварцево-песчаных породах; · 7) почвы контактно-глеевые (формируются на двучленных породах, когда супесчаные или песчаные толщи подстилаются суглинистыми или глинистыми отложениями; на контакте смены наносов образуется осветленная полоса, образующаяся за счет периодического переувлажнения); · 8) остаточно-аридные. Виды почв выделяются в пределах рода по степени выраженности основного почвообразовательного процесса, свойственного определенному почвенному типу. Для наименования видов используют генетические термины, указывающие на степень развития этого процесса. Так, для подзолистых почв — степень подзолистости и глубина оподзоливания; для черноземов — мощность гумусового горизонта, содержание гумуса, степень выщелоченности; для солончаков — характер распределения солей по профилю, морфология поверхностного горизонта (пухлые, отакыренные, выцветные). Внутри видов определяются разновидности почв. Это почвы одного и того же вида, но обладающие различным механическим составом (например, песчаные, супесчаные, суглинистые, глинистые). Почвы же одного вида и одного механического состава, но развитые на материнских породах разного происхождения и разного петрографического состава, выделяются как почвенные разряды. Дерново-подзолистые почвы - отличаются невысоким содержанием гумуса (0,5-2,5%) и небольшим гумусовым слоем (10-20 см), в связи с этим - невысоким естественным плодородием и, как правило, кислой реакцией (рН=4-5). В большинстве случаев они пере увлажнены. Нуждаются в дренажных и других осушительных работах, увеличении гумусового горизонта, а также регулярном известковании и внесении повышенных доз органических удобрений или землевании. Дерново-карбонатные почвы. В отличие от дерново-подзолистых почв обладают более высокой продуктивностью (гумус - 2-4%), меньшей кислотностью рН=6 и более благоприятными физико-механическими показателями. Для получения высоких урожаев нуждаются только в повышенных дозах органических и минеральных удобрений. Серые лесные почвы. По многим показателям близки к дерново-карбонатным почвам (только несколько выше кислотность (рН—5,5-6,5). Они склонны к замыванию и переуплотнению. Нуждаются в периодическом известковании, углублении пахотного горизонта, а также в удобрении фосфором и азотом. Торфяно-болотные почвы. Характеризуются высоким естественным плодородием и большим содержанием азота (2-4%), низким содержанием фосфора, высокой кислотностью (рН=3,5-5) и низкими физико-механическими свойствами. Нуждаются в регулировании водного режима (осушение-орошение), внесении фосфорно-калийных удобрений, регулярном известковании и внесении микроэлементов. Черноземные почвы. Лучшие из почв по всем показателям (уровню плодородия, глубине гумусового горизонта (если не эродированы), содержанию макро- и микроэлементов и физико-механическим параметрам почвы). Оподзоленные черноземы склонны к заиливанию и переуплотнению, а карбонатные черноземы бедны железом : в доступной для растений форме (провоцируется хлороз винограда и плодовых). 2 Методика определения гигроскопической влаги почвы Навеску почвы 2-5 г берут на аналитических весах в предварительно высушенных при температуре 100-105 0С и взвешенных стеклянных бюксах (бюксы взвешивают с крышками). Бюксы с почвой в течение 5 ч выдерживают в сушильном шкафу при температуре 100-1050С. С помощью щипцов с резиновыми наконечниками бюксы вынимают из сушильного шкафа, закрывают крышками, охлаждают в эксикаторе и взвешивают. Условились считать, что выдерживание почвы в течение 5 ч при температуре 100-1050С приводит к полной потере гигроскопической влаги. Если необходимо проверить полноту удаления гигроскопической влаги, бюксы с почвой снова ставят в сушильный шкаф на 1,5-3 ч и взвешивают. Высушивание прекращают, если масса равна или больше результата предыдущего взвешивания (увеличение массы может произойти за счет окисления некоторых компонентов почв). Расчет массовой доли гигроскопической влаги (%) проводят по уравнению:
Где m – масса воздушно-сухой почвы, г; m1 – масса высушенной почвы, г. 2.1 Определение C и органических соединений по Тюрину Приборы и реактивы:Аналитические весы, Колба коническая термостойкая на 100 мл.,воронка стеклянная диаметром 3см,бюретка на 25 мл.,пипетка медицинская,фильтровальная бумага, хромовая смесь 0,4н,соль Мора 0,2 н, ФАК 0,2%,KMnO4. Ход работы: Взять мелкодисперсную навеску 0,5 г,Поместить в колбу емкостью 100 мл. Затем в колбочки пипеткой прилить по каплям 10 мл 0,4 н р-ра K2Cr2O7 в H2SO4.Осторжно взболтать и поставить на эл. плитку.Кипятят 5 минут,одновременно проводят холостое кипячение без почвы, только 10 мл K2Cr2O7. После кипячения колбы охлаждают. Смывают капли хромовой смеси дистиллированной водой в колбочку и, добавив 4-5 капель 0,2% р-ра ФАК, титруют 0,2 н соли Мора.Переход окраски из вишнево-фиолетовой в зеленую. Одновременно проводят холостое титрование. По объему соли Мора, пошедшего на титрование,определяют колличество хромовой смеси, не израсходованной на окисление органического вещ-ва почвы. При титровании солью Мора избытка K2Cr2O7 происходит реакция: 6FeO4 (NH4) 2SO4+K2Cr2O7+7H2 SO4=Cr2(SO4)3+3Fe2(SO4)3+6(NH4)2SO4+ K2SO4+7H2O Содержание углерода вычисляют по формуле: C%=((Vхол-Vраб)*N*0.003*100)/a , Где Vхол-объем соли Мора(мл) пошедший на титрование 10 мл K2Cr2O7. 2.2 Определение фенола в почве Приборы и реактивы: п-нитроаналин,NaNo2(1н), Н2SО4(разбавл), Na2CO3(2н), смесь: уксуская кислота- бутанол- вода (3:5:2) Ход работы: Растворяют 5г фенола в дистиллированной воде , разбавляют до 1л.Отбирают 1мл этого раствора , содержащий 5 мл фенола , вносим в делительную воронку, прибавляем 1 мл H2SО4, 25 мл Na2СО3, 2,5 мл п-нитроаналина. Затем прибавляем еще 50 мл H2SО4 и экстрагируют краситель 50 мл хлорбензола. Бензольный экстракт фильтруют в 50 мл колбу и доводят до метки чистым хлорбензолом (0,1 мл фенола содержит). Далее вносим на покрытое смесью стекло, следующие концентрации: 5,0; 10,0; 20,0; 70,0; и Х мкг. Помещаем пластинку в хроматографическую камеру. Пятна фенола (розово-сиреневого цвета) появляются на расстоянии 1-15 см от стартовой линии.(Rf=0.1). Каждое пятно экстрагируют изопропанольной смесью и измеряют оптическую плотность экстрактов при λ=540нм. По градуировочному графику находят содержание фенола. 2.3 Определение общей щелочности и щелочности, обусловленной карбонат-ионами Навеску почвы массой 40,0 г помещают в сухую колбу или другую емкость вместимостью 250 мл. К почве с помощью мерного цилиндра приливают 100 мл. 1 М раствора KCl. Содержимое колбы взбалтывают 1 час и фильтруют через складчатый фильтр в сухую коническую колбу. Чтобы получить прозрачные фильтраты, на фильтр переносят как можно больше почвы. Первые порции фильтрата могут опалесцировать, их перефильтровывают. Вытяжка должна быть прозрачной. В полученной 1 М KCl-вытяжке определяют концентрацию карбонат-ионов. Для этого из мерной колбы в коническую колбу для титрования вместимостью 100 мл прибавляют 25 мл аликвоты раствора и несколько капель фенолфталеина. Титруют 0,01 М раствором H2SO4 до обесцвечивания розовой окраски раствора. Записывают объем титранта V1, пошедший на титрование. Далее определяют общую щелочность. Для этого из мерной колбы в коническую колбу для титрования вместимостью 100 мл прибавляют 25 мл аликвоты раствора и несколько капель метилового-оранжевого. Титруют 0,01 М раствором H2SO4 до изменения окраски раствора из желтой в оранжевую. Записывают объем титранта V2, пошедший на титрование. Концентрацию карбонат-ионов и общую щелочность вычисляют по формулам:
где н – нормальность кислоты; Vа – объем аликвоты, мл; V0 – объем, добавленный к навеске почвы, мл; m – навеска почвы, г. 2.4 Методика комплексонометрического определения валового содержания железа в почвах На конических колбах вместимостью 250 мл делают отметку на уровне, соответствующем объему 50 мл. В колбу помещают 25 мл фильтрата, полученного после отделения кремниевой кислоты, добавляют 5-7 капель концентрированной азотной кислоты и нагревают до кипения, окисляя Fe(II). Затем в колбу добавляют 10-15 капель 25%-ного раствора аммиака, помещают кусочек индикаторной бумаги Конго-рот и добавляют по каплям сначала 25%-ный раствор аммиака, а затем 10%-ный до перехода синей окраски индикаторной бумаги в бурую. Если при этом выпадет осадок, его растворяют несколькими каплями 1 н. HCl. В колбу приливают 5 мл 1 н. HCl, и объем жидкости дистиллированной водой доводят до отметки, соответствующей 50 мл. Содержимое колбы нагревают до 50-60 °С, добавляют 1-3 капли 10%-ного раствора сульфосалициловой кислоты и титруют 0,01 М раствором комплексона III до перехода лиловой окраски сульфосалицилата железа в бледно-желтую комплексоната железа. Скорость реакции невелика, поэтому последние порции титранта добавляют медленно. Если в этой же порции анализируемого раствора будет определяться алюминий, нельзя добавлять избытка титранта. 2.5 Определение кальция и магния при совместном присутствии Константы устойчивости этилендиаминтетраацетатов кальция и магния различаются на 2 порядка. Поэтому эти ионы нельзя оттитровать раздельно, используя только различие в константах устойчивости комплексонатов. При pHопт ~ 10 в качестве металлоиндикаторов используют эриохромовый черный Т. При этих условиях определяют сумму кальция и магния. В другой аликвотной части создают pH > 12, вводя NaOH, при этом магний осаждается в виде гидроксида, его не отфильтровывают, и в растворе определяют комплексонометрический кальций в присутствии мурексида, флуорексона или кальциона, являющихся металлоиндикаторами на кальций. Магний определяют по разности. Выполнение определения. 1. Определение суммы кальция и магния. Отбирают пипеткой 10 мл анализируемого раствора (водной вытяжки почвы) из мерной колбы вместимостью 100 мл в коническую колбу для титрования вместимостью 100 мл, прибавляют 2-3 мл буферного раствора с pH 10, 15 мл воды, перемешивают и прибавляют на кончике шпателя 20-30 мг смеси эриохромового черного Т и хлорида натрия. Перемешивают до полного растворения индикаторной смеси и титруют раствором ЭДТА до изменения окраски раствора из винно-красной в голубую. 2. Определение кальция. Отбирают пипеткой 10 мл анализируемого раствора (водной вытяжки почвы) в коническую колбу для титрования вместимостью 100 мл, прибавляют 2-3 мл раствора NaOH или KOH, разбавляют водой примерно до 25 мл, вводят 20-30 мг индикаторной смеси мурексида, флуорексона, или кальциона с хлоридом натрия и титруют раствором ЭДТА до изменения окраски раствора от одной капли раствора ЭДТА. Изменение окраски в конечной точке титрования зависит от выбранного металлоиндикатора. При использовании мурексида окраска изменяется из розовой в фиолетовую; при использовании флуорексона – из желтой с зеленой флуоресценцией в бесцветную или розовую с резким уменьшением интенсивности флуоресценции; при использовании кальциона – из бледно-желтой в оранжевую. В последнем случае щелочную среду создают только 2 М раствором KOH. 3. Определение магния. Объем титранта, израсходованный на титрование магния, вычисляют по разности объемов ЭДТА, пошедшей на титрование при pH 10 и при pH 12. 2.6 Методика определения обменной кислотности Навеску почвы, пропущенной через сито с отверстиями диаметром 1-2 мм, массой 40 г помещают в колбу вместимостью 250 мл. В колбу приливают 100 мл 1М раствора KCl и взбалтывают в течение 1 ч. Часовое взбалтывание суспензии может быть заменено трехминутным взбалтыванием с последующим суточным настаиванием. Содержимое колбы фильтруют в сухую коническую колбу или другую емкость. Первые 10 мл фильтрата выбрасывают. После того, как суспензия будет профильтрована полностью, 50 мл фильтрата помещают в коническую колбу вместимостью 250 мл, добавляют 2-3 капли фенолфталеина и титруют 0,02-0,1М раствором NaOH до появления розовой окраски, не исчезающей в течение 1 мин. Обменную кислотность (Ноб) рассчитывают по уравнению:
Где V и V1 – объем NaOH, пошедший на титрование соответственно аликвоты вытяжки и контрольной пробы; н – молярная концентрация NaOH, ммоль/мл; Vал и V0 – объем аликвоты вытяжки и общий объем добавленного к почве 1М KCl, мл; m - навеска почвы, г. Реагенты: 1М раствор KCl растворяют в 300-400 мл дистиллированной воды, раствор фильтруют и объем доводят до 1 л. Значение рН раствора соответствует 5,6-6,0 (рН дистиллированной воды, находящейся в равновесии с СО2 атмосферного воздуха, имеет рН около 5,6). 2.7 Методика определения гидролитической кислотности В сухую колбу вместимостью 250 мл помещают навеску почвы, пропущенной через сито с отверстиями диаметром 1 мм, массой 40,0 г. В колбу приливают 100 мл 1М раствора СН3СООNa и взбалтывают в течение часа. Часовое взбалтывание может быть заменено 3 минутным с последующим 18-20 часовым настаиванием с периодическим (4-5 раз) взбалтыванием суспензии. Суспензию взбалтывают круговыми движениями и фильтруют через сухой складчатый фильтр. Первые порции (около 10 мл) фильтрата выбрасывают. Если затем при фильтровании получают мутный раствор, его перефильтровывают. Аликвоту фильтрата 50 мл помещают в коническую колбу вместимостью 250 мл, добавляют 2-3 капли фенолфталеина и титруют 0,02-0,1 н раствором NaOH до слабо-розовой окраски, не исчезающей в течение 1 мин. Гидролитическую кислотность рассчитывают по уравнению: Нг моль(+)/100 г почвы = [VнV0100]/[Vалm], Где V и н – объем и концентрация раствора NaOH, ммоль/мл; Vал - объем аликвоты вытяжки, мл; V0 – объем добавленного к навеске почвы раствора ацетата натрия, мл; m - навеска почвы, г. Если полученный результат умножают на 1,75 для компенсации неполного извлечения из почв кислотных компонентов при однократной обработке почвы экстрагирующим раствором, в комментарии к результатам анализа делают соответствующую оговорку. Реагенты: 1М раствор СН3СООNa с рН 8,3. Навеску ацетата натрия 82,0 г СН3СООNa или 136,0 г СН3СООNax3Н2О растворяют в дистиллированной воде ,(если необходимо, фильтруют), доводят объем до 1 л и измеряют рН. Величину рН доводят до 8,3 растворами СН3СООNa или NaOH с массовой долей 10%. Контроль рН раствора может быть осуществлен с помощью фенолфталеина. Раствор ацетата натрия при добавлении фенолфталеина должен иметь слабо-розовую окраску. 2.8 Методика определения концентрации фосфатов в 0,03 н. K2SO4-вытяжках (по Карпинскому – Замятиной) Навеску почвы массой 20,0 г помещают в сухую колбу или другую емкость вместимостью 250 мл. К почве с помощью мерного цилиндра приливают 100 мл. 0,03 н. раствора K2SO4. Содержимое колбы взбалтывают 5 мин и фильтруют через складчатый фильтр в сухую коническую колбу. Чтобы получить прозрачные фильтраты, на фильтр переносят как можно больше почвы. Первые порции фильтрата могут опалесцировать, их перефильтровывают. Вытяжка должна быть прозрачной.В полученной 0,03 н. K2SO4-вытяжке определяют концентрацию фосфатов. Для этого в мерную колбу вместимостью 50 мл. помещают 20-40 мл. вытяжки. В колбу добавляют 8 мл. реагента Б. Объем жидкости в колбе доводят дистиллированной водой до метки, тщательно перемешивают и через 10 мин. Измеряют оптическую плотность раствора при длине волны 630-882 нм. Перед окрашиванием анализируемого раствора необходимо приготовить шкалу стандартных растворов для получения градуировочной кривой. С этой целью в мерные колбы вместимостью 50 мл. приливают по 2 мл. 0,6 н. K2SO4, что обеспечит концентрацию сульфата калия в находящемся в колбе растворе приблизительно такую же, какую получают при анализе 40 мл K2SO4-вытяжки. Затем в каждую из колб с помощью бюретки приливают стандартный раствор с содержанием фосфора 0,005 мг P в 1 мл. В колбы добавляют 0,5; 1,0; 3,0; 5,0; 7,0 и 10,0 мл стандартного раствора. В колбы приливают дистиллированную воду приблизительно до объема 35 – 40 мл, реагент Б. Содержимое колб тщательно перемешивают, через 10 мин измеряют оптическую плотность и строят градуировочную кривую в координатах: оптическая плотность – количество фосфора в мерной колбе. По градуировочной кривой находят концентрацию фосфора в анализируемых растворах. Результаты анализа выражают в мг/л: P, мг/л = Cp1000/Vал, где Vал – объем аликвоты вытяжки, мл; Сp – число миллиграммов фосфора в мерной колбе, мг/объем мерной колбы. 3 Экспериментальная часть В экспериментальной части проводился анализ почвы. Почва была отобрана в Усманском районе, Липецкой области. Проба отбиралась с глубины около 20 см, масса пробы составила 0,5 кг. 3.1 Определение гигроскопической влаги 1. Таблица полученных результатов:
ωср, % = 35,30% 2. Статистическая обработка данных.
Sr = S/xср - относительное стандартное отклонение Sr = 1.394/35.3 = 0.039
ω 3.2 Определение C и органических соединений по Тюрину Vхол =40 мл Vраб=10 мл а=0,5 г С%=(30*0,2*0,003*100)/0,5=3,6% 2. Определение фенола Таблица полученных результатов
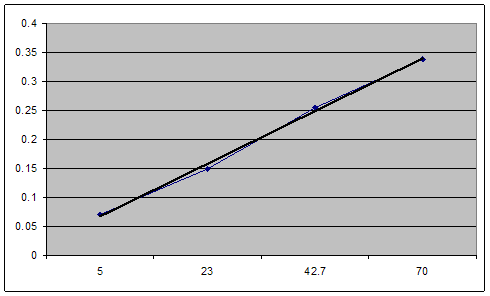
Градуировочный график
Из графика видно, что
Статистическая обработка данных. S= Sr = 2,08/40 = 0,052
С Пересчитаем концентрацию: С=0,02г/20г почвы 3.3 Определение общей щелочности и щелочности, обусловленной карбонат-ионами 1. Таблица полученных результатов:
2. Карбонатная щелочность.
Статистическая обработка данных. S= Sr = 0,0031/0,409 = 0,006
С 3.4 Общая щелочность ОЩ1= ОЩ2= ОЩ3= ОЩср=1,745 ммоль/100г почвы
Статистическая обработка данных. S= Sr = 0,06/1,808 = 0,033 Т= С 3.5 Валовое содержание железа 1. Таблица полученных результатов:
С учетом разбавления: С1 = 0,0080 моль/л С2 = 0,0076 моль/л С3= 0,0084 моль/л Сср = 0,0080 моль/л. mFe3+ = 0,0080·56·0,1 = 0,0448 г. ω, %= 2. Статистическая обработка данных. S= Sr = 0,002/0,0080 = 0,25 Т= С 3.6 Определение кальция и магния при совместном присутствии 1. Определение суммы кальция и магния СТ = 0,1 моль-экв/л Vал = 10 мл
Статистическая обработка результатов S= Sr = 0,00026/0,0203 = 0,0128 Т= Ср ср±ΔC=(0,02030 ± 0,00061)ммоль экв/мл m∑ = 0,056 + 0,0128 = 0,069 ω%=0,203% 2. Определение кальция Vал = 10 мл Ст = 0,1 моль экв/л
Статистическая обработка результатов S= Sr = 0,0015/0,0136 = 0,11 Т= Ср ср ± ΔC = (0,0136 ± 0,0037)ммоль экв/мл ω%=mCa/ mн mCa = 0.0136·40·0.1 = 0,0544 г ω%=0,19% 3.Определение магния Vал = 10 мл Ст = 0,1 моль экв/л
Статистическая обработка результатов S= Sr=0,00024/0,0072 = 0,033 Т= Ср ср ± ΔC = (0,0072 ± 0,00054)ммоль экв/мл mMg = 0,0072·24·0,1 = 0,01761 г ω%=0,071% 3.7 Определение обменной кислотности 1. Таблица полученных данных
2. Статистическая обработка результатов S= Sr=0,03/1,40 = 0,028 Т= Ср ср±ΔC=(1,40±0,020)ммоль/100 г почвы 3.8 Определение концентрации фосфатов в 0,03 н. K2SO4-вытяжках (по Карпинскому – Замятиной) 1. Построение градуировочного графика. График: оптическая плотность – объем аликвоты.
С1
= С2
= С3
= Сср = 3,27 мг/100 г = 3,27·10-3 г/100 г ω%=( Ср ср/10)·100% = 0,0327% 2. Статистическая обработка результатов S= Sr=0,016/3,27 = 0,048 Т= Ср ср±ΔC=(3,27±0,039)мг/100 г 3.9 Определение гидролитической кислотности 1. Таблица полученных результатов
2. Статистическая обработка результатов S= Sr=0,018/0,51 = 0,02 Т= Ср ср±ΔC=(0,51±0,059)ммоль/100 г почвы. 3.10 Определение нитрат ионов в почве с использованием нитрат селективного электрода Результаты определений занесены в таблицу:
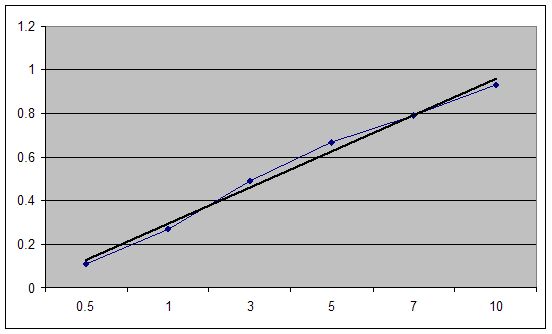
По результатам построен график 1.
Концентрации найденные по градуировочному графику приведены в таблице:
Статистическая обработка результатов S= Sr=0,00006/0,000135 = 0,04 Т= Ср ср±ΔC=(0,000135±0,009)ммоль/100 г почвы. Пересчитаем концентрацию: с = сNO3 *14*105/1-(w/100) С=0,000135*15/1-(35,3/100)=0,034мг/кг Заключение В ходе данной работы был проанализирован образец почвы, отобранный в Усманском районе Липецкой области. Полученные результаты представлены в таблице:
Библиографический список 1 Химический анализ почв/ Воробьева Л.А. – М.: изд. МГУ, 1998. – 272с.: ил. 2 Эколого-аналитический мониторинг стойких органических загрязнителей/ Майстренко В.Н., Клюев Н.А. – М.: Мир: БИНОМ. Лаборатория знаний, 2004. -323с.: ил. 3 Основы аналитической химии. Практическое руководство: уч. Пособие для ВУЗов/ Фадеева В.И., Шеховцова Т.Н., Иванов В.М. и др.; под ред. Золотова Ю.А. – М.: Высшая школа, 2001. – 463с: ил. 4 Агрохимические исследования почв/Под ред. А.В.Соколова. М.: Наука, 1975. 98 с. 5 Учебно-полевая практика и лабораторные работы,методическое пособие/Дербенцева А.М.,Пилипушка В.Н.-Владивосток,2005.-24с. 6 Практикум по агрохимии/Под ред. МинееваВ.Г. М.:Изд-во МГУ,2001.-689 с. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
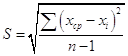 -
стандартное отклонение
-
стандартное отклонение