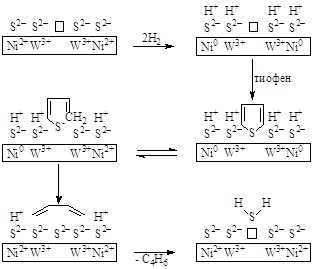- Главная
- Авиация и космонавтика
- Административное право
- Акционерное право
- Английский
- Антикризисный менеджмент
- Биографии
- Автомобильное хозяйство
- Автотранспорт
- Культура и искусство
- Маркетинг
- Международное публичное право
- Международное частное право
- Международные отношения
- Менеджмент
- Металлургия
- Муниципальное право
- Налогообложение
- Оккультизм и уфология
- Педагогика
- Политология
- Право
- Предпринимательство
- Психология
- Радиоэлектроника
- Риторика
- Социология
- Статистика
- Страхование
- Строительство
- Схемотехника
- Таможенная система
- Теория государства и права
- Теория организации
- Теплотехника
- Технологии
- Товароведение
- Транспорт
- Трудовое право
- Туризм
- Уголовное право и процесс
- Управление
- Сочинения по литературе и русскому языку
- Другое
Реферат: В органическом синтезе в реакциях гидрирования участвуют любые молекулы, имеющие ненасыщенные связи. Синтезы Фишера-Тропша. Обратная гидрированию реакция - процесс дегидрирования в промышленном органическом синтезе и в процессах нефтепереработки.Реферат: В органическом синтезе в реакциях гидрирования участвуют любые молекулы, имеющие ненасыщенные связи. Синтезы Фишера-Тропша. Обратная гидрированию реакция - процесс дегидрирования в промышленном органическом синтезе и в процессах нефтепереработки.Процессы гидрирования и дегидрирования в органическом синтезе и в нефтехимииВ органическом синтезе в реакциях гидрирования (присоединения H2) участвуют любые молекулы, имеющие ненасыщенные связи – С=С, СºС, СºN, –N=N–, C=O и др. Синтезы Фишера-Тропша из СО и Н2, синтез метанола из СО, СО2 и Н2 также относят к реакциям гидрирования, однако в синтезе углеводородов по Фишеру-Тропшу, кроме присоединения Н2, происходит и деструктивное гидрирование с разрывом С–О связи. К деструктивному гидрированию относится и гидрогенолиз связи С–С – процессы гидрокрекинга, например,
и гидрогенолиз связи С–S (процессы гидрообессеривания нефтяных фракций)
Обратная гидрированию реакция – процесс дегидрирования – занимает важное место в промышленном органическом синтезе и в процессах нефтепереработки. Дегидрируют алканы и алкилбензолы (синтезы бутадиена, изопрена, стирола), нафтены (бензол из циклогексана), спирты (синтезы формальдегида, ацетона, изовалерианового альдегида, циклогексанона). В качестве катализаторов гидрирования используют металлы и их соединения: Металлические катализаторы – Pt, Pd, Ni, Co, Rh, Ru, Cu – в форме массивных металлов, сплавов, нанесенных катализаторов (М/носитель) и скелетных металлов (никель Ренея, медь Ренея), которые получают выщелачиванием Al из сплавов Al-Ni, Al-Cu и др. Сульфиды металлов – NiS, CoS, Mo2S3, W2S3. Комплексы переходных металлов. Оксиды металлов применяют для процессов дегидрирования, поскольку при высоких температурах (> 200оС) металлы слишком активны и ведут деструктивные процессы. Катализаторами дегидрирования являются следующие оксиды: ZnO, Cr2O3, Mo2O3, W2O3, MgO. При высоких температурах (> 450оС) дегидрирование спиртов наблюдается и на g-Al2O3. Важнейшая стадия процессов гидрирования – активация молекулы водорода. В случае комплексов металлов в растворах механизм активации водорода сейчас уже ясен:
Превращение первичного s-комплекса зависит от природы металла, его степени окисления и лигандов в координационной сфере. Возможны гомолиз (2) и гетеролиз (3) связи Н-Н:
Участия недиссоциированной молекулы H2 в процессах гомогенного гидрирования пока не установлено. Гидрогенолиз связи М-С, например, в процессе гидроформилирования олефинов
также рассматривают как результат гомолитического расщепления молекулы Н2 на атоме Со. Не исключена, однако, возможность элементарного акта (метатезис s-связей) через четырехчленное циклическое переходное состояние
На поверхности металлов имеет место гомолитическое расщепление Н2 с образованием поверхностных атомов водорода и атомов водорода, растворенных в решетке металла. При наличии полярного растворителя (S) процесс адсорбции Н2 на металлах может проходить гетеролитически и даже сопровождаться полной ионизацией с переносом 2ē на металл.
В этом случае молекулу гидрируемого соединения восстанавливают электроны, связанные с металлом. При построении кинетических моделей процессов гидрирования на металлах используют представления об однородной поверхности, о равномерно-неоднородной поверхности (модели Лэнгмюра-Хиншельвуда) и о неоднородной поверхности. Например, при гидрировании этилена в рамках гипотезы о взаимодействии адсорбированных на поверхности Niтв этилена и водорода
На однородной поверхности
На равномерно-неоднородной поверхности
Для процесса дегидрирования бутана до бутилена на катализаторе Cr2O3/Al2O3 при 520 – 550оС используют эмпирическое уравнение (8) (для промышленного интервала парциальных давлений):
Гидрокрекинг углеводородов Процесс используют для получения легких бензинов, дизельного топлива и смазочных масел. Высококипящие фракции (главным образом, вакуумный дистиллят) обрабатывают водородом при Р = 50 – 300 атм и 330 – 450оС в присутствии катализаторов – Rh, Ni, Co, Mo, Pt на Al2O3. В случае Ni преимущественно происходит активация и гидрогенолиз концевых С-С связей в алканах с образованием СН4 и более коротких углеводородов. Металлическая Pt активирует все связи, в том числе и связи С-Н, катализируя процессы деструкции и дегидрирования. Алюмокобальтмолибденовый катализатор гидрокрекинга используют при ~400оС и Р = 50 атм. Основные реакции в процессе гидрокрекинга – гидрирование ароматических полициклических соединений, раскрытие нафтеновых колец, гидродеалкилирование алкилароматических и нафтеновых углеводородов, изомеризация и гидрирование образующихся продуктов, а также гидрогенолиз сера-, азот- и кислородсодержащих соединений (до H2S, NH3 и H2O), т.е. процессы гидроочистки. Важное место среди процессов гидрокрекинга, позволяющих получить средний дистиллят в качестве дизельного топлива с пониженной плотностью и повышенным цетановым числом занимают процессы гидрирования полициклических ароматических соединений и последующего гидрогенолиза полученных нафтенов (раскрытие циклов) без потери молекулярной массы нафтенов, например,
Для таких процессов наилучшие результаты получены для катализаторов Pt/Al2O3, Rh/Al2O3 и Ir/Al2O3. В гидрокрекинге применяют и полифункциональные катализаторы, содержащие Pt и цеолиты средней или низкой кислотности. Каталитический риформинг Процесс риформинга направлен на изомеризацию и ароматизацию н-парафинов без изменения молекулярной массы (числа атомов углерода) в исходных молекулах в процессе превращений. Основные реакции: а) ароматизация
б) дегидроциклизация парафинов
в) скелетная изомеризация
г) дегидрирование
(с последующей скелетной изомеризацией олефинов) Процессы гидрокрекинга являются нежелательными.
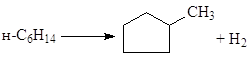
Риформинг используют для получения из нафты (температура кипения 80 – 160оС) высокооктановых бензинов и ароматических соединений, которые экстрагируют из бензинов и используют в качестве сырья для гидрокрекинга или для органического синтеза. Процесс проводят в интервале 380 – 520оС при давлении 10 – 40 атм на гетерогенных бифункциональных катализаторах – металлических и кислотных – Pt на промотированном Cl– или F– оксиде алюминия (или алюмосиликате). В последнее время используют Pt-Re/Al2O3 или полиметаллические катализаторы на Al2O3. Основной проблемой в процессе риформинга является процесс дезактивации и закоксовывания катализатора. Наличие Pt и, особенно, Re способствует уменьшению коксообразования по сравнению с процессом каталитического крекинга на алюмосиликатах – происходит гидрирование отлагающегося на носителе кокса и полимерных пленок. На рисунке представлена упрощенная диаграмма реакций (на примере превращений С6-углеводородов), развивающихся на кислотных центрах (вдоль оси абсцисс) и на металлических центрах (вдоль оси ординат):
Установлено также, что процессы дегидроциклизации парафинов могут проходить и целиком на металлических центрах, минуя стадию образования олефина, представленную на диаграмме. Разрыв С-Н связей в парафине на соседних центрах (атомах Pt) происходит с образованием s-металлоорганических и металлкарбеновых интермедиатов:
Гидрогенолиз связей 2-3, 3-4 и 4-5 приводит к продуктам скелетной изомеризации н-алканов. Изучена кинетика 53 индивидуальных реакций, характерных для риформинга бензиновой фракции, определены константы скорости первого порядка для различного вида углеводородов С6 – С10 и различных реакций. Получена упрощенная кинетическая модель очень сложного мультимаршрутного процесса риформинга, которую используют для расчета промышленных реакторов. Гидрообессеривание (гидроочистка) Процессы удаления серасодержащих соединений, присутствующих в нефтяных фракциях (и природном газе), включают процессы демеркаптанизации (окисление RSH) и гидрообессеривания (гидрирование алифатических и гетероциклических сульфидов). Последний процесс используют для предварительной обработки сырья риформинга и для обработки бензина, полученного в процессе каталитического крекинга. Обессеривание тяжелых фракций нефти дает продукты, включающие дизельное и реактивное топливо, котельное топливо и топливный мазут. Катализаторы процесса – оксиды Co и Mo на Al2O3 или оксиды Ni и W на Al2O3, которые в условиях процесса взаимодействуют с H2S и переходят в сульфиды металлов. Такие катализаторы существенно менее активны по сравнению с Pt/Al2O3, но они не отравляются H2S. Процесс проводят в интервале температур 330 – 425оС и давлений 35 – 140 атм, в зависимости от вида фракции, подвергаемой гидроочистке. Регенерация катализаторов достигается путем выжигания кокса, образующегося на катализаторах. При исследовании кинетики реакций (9), (10) и (11)
на катализаторах CoS-Mo2S3/Al2O3 были получены кинетические уравнения в рамках схемы Лэнгмюра-Хиншельвуда
где РТ – парциальное давление тиофена, Pi – парциальные давления тиофена и др. ароматических углеводородов.
Из уравнений (12) и (13) следует, что оба процесса – гидрогенолиз (9) и гидрирование бутена (11) происходят на разных центрах катализатора. Механизм реакции пока не ясен, однако упрощенная стадийная схема включает активацию Н2 на металле восьмой группы (Ni2+, Co2+) и адсорбцию тиофена на анионной вакансии, связанной с Mo(III) или W(III). Восстановленные атомы Ni(0) и осуществляют разрыв связи C-S:
Схематически на поверхности сульфидного катализатора, представленного в ионной форме, происходят следующие процессы ( – анионная вакансия):
На ионах, расположенных в прямоугольнике, могут находиться делокализованные электроны. Появились уже примеры гидрогенолиза связей C-S с участием комплексов переходных металлов. Исследования таких систем позволят установить механизм процесса и природу возможных интермедиатов. Вопросы для самоконтроля Назовите катализаторы гидрирования и дегидрирования органических соединений. Охарактеризовать механизм активации водорода комплексами металлов и металлами. Варианты кинетических моделей процессов гидрирования. Назвать основные реакции в процессе гидрокрекинга – газоочистки нефтяных фракций. Основные реакции процесса риформинга. Описать механизм реакции дегидрирования на платиновых катализаторах. Представить схематически возможный механизм гидрогенолиза тиофена на Ni-W-катализаторах. Литература для углубленного изучения Гейтс Б., Кетцир Дж., Шуйт Г., Химия каталитических процессов, М., Мир, 1981, с. 227 – 390, с. 476 – 543. Шапиро Р.Н., Каталитический риформинг бензинов, Химия и технология, Л., 1985. Эрих В.Н., Расина М.Г., Рудин М.Г., Химия и технология нефти и газа, Л., Химия, 1985, с. 214 – 281. |
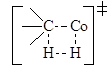 .
.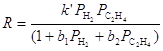 (6)
(6)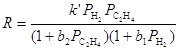 (7)
(7)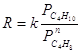 , n = 0.4 – 0.5 (8)
, n = 0.4 – 0.5 (8)

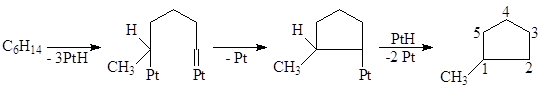
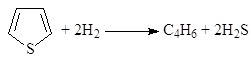 (9)
(9)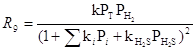 , (12)
, (12)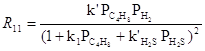 (13)
(13)